Trimetilalumínio
| Trimetilalumínio Alerta sobre risco à saúde | |
|---|---|
| |
| Nome IUPAC | trimethylalumane |
| Outros nomes | Trimethylaluminium; aluminium trimethyl |
| Identificadores | |
| Número CAS | |
| PubChem | |
| ChemSpider | |
| SMILES |
|
| InChI | 1/3CH3.Al/h3*1H3;/rC3H9Al/c1-4(2)3/h1-3H3
|
| Propriedades | |
| Fórmula molecular | C6H18Al2 |
| Massa molar | 144.18 g/mol |
| Aparência | Liquido incolor |
| Densidade | 0.752 g/mL |
| Ponto de fusão |
15 °C |
| Ponto de ebulição |
125 °C |
| Riscos associados | |
| Principais riscos associados |
Pirofórico |
| NFPA 704 | |
| Página de dados suplementares | |
| Estrutura e propriedades | n, εr, etc. |
| Dados termodinâmicos | Phase behaviour Solid, liquid, gas |
| Dados espectrais | UV, IV, RMN, EM |
| Exceto onde denotado, os dados referem-se a materiais sob condições normais de temperatura e pressão Referências e avisos gerais sobre esta caixa. Alerta sobre risco à saúde. | |
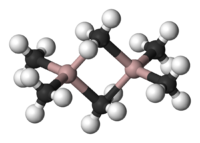
Trimetilalumínio é um composto químico de fórmula Al2(CH3)6,abreviado como Al2Me6, (AlMe3)2 ou pela abreviação TMA.Esse liquido incolor e pirofórico é um importante composto organoalumínico industrial.Evolve uma fumaça branca (óxidos de alumínio) quando seus vapores entram em contato com ar.
Estrutura e ligações[editar | editar código-fonte]

Al2(CH3)6 existe como um dímero, análogo à estrutura do diborano. Assim como no diborano, os elementos estão ligados por uma ligação três centros dois elétrons. O átomo de alumínio está ligado covalentemente e está deficiente de elétrons, realizando ligações tricentradas para completar seu octeto. O grupo metil compartilhado liga os dois átomos de alumínio. O Al-C terminal e a ponte de ligamento Al-C tem distância de 1,97Å e 2,14 Å respectivamente.[1] Os átomos de carbono do grupo metil central tem 5 vizinhos: três átomos de hidrogênio e dois de alumínio. O carbono dos grupos metil em ponte está realizando quatro ligações covalentes: três ligações simples C–H e uma ligação tricentrada com dois elétrons com dois átomos de alumínio. Os grupos metil interagem prontamente tanto de forma intramolecular como intermolecular. Ligações tricentradas são ligações deficientes de elétrons, portanto menos estáveis do que ligações covalentes normais, de forma que tendem a reagir com bases de Lewis resultando em produtos com ligações dois centros dois elétrons convencionais. Por exemplo a reação com aminas resultaria em adutos R3N — Al(CH3)3.Outra reação que gera produtos que segue a regra do octeto é a de Al2(CH3)6 com tricloreto de alumínio para resultar em (Al(CH3)2Cl)2. A espécie química Al(CH3)3, que teria um átomo de alumínio central ligado a três grupos metila é desconhecida. A teoria VSEPR prediz que tal molécula teria uma geometria trigonal plana, assim como observado no B(CH3)3.
Síntese e aplicações[editar | editar código-fonte]
TMA pode ser preparado por um processo que pode ser sumarizado pela seguinte reação:
2 Al + 6 CH3Cl + 6 Na → Al2(CH3)6 + 6 NaCl
TMA é usado principalmente na produção de metilaluminoxano (MAO), um ativador para catalisadores Ziegler Natta usados na polimerização de olefinas.TMA também é empregado como um agente metilante. O reagente de Tebbe, que é usado para a metilação de ésteres e cetonas,é preparado a partir do TMA. TMA é frequentemente usado como traçante em foguetes para teste de padrões de vento na atmosfera superior. TMA também é usado na fabricação de semicondutores, para crescer um fino filme de óxido de alumínio via o processo de Deposição química em fase de vapor ou deposição de camada atômica. TMA forma complexo com a amina terciaria DABCO, o complexo é mais seguro para transporte que TMA puro[2]. Em combinação com Cp2ZrCl2 (dicloreto de zirconoceno), o (CH3)2Al-CH3 adiciona alcinos transversais para dar espécies de vinil alumínio que são úteis em síntese orgânica em uma reação conhecida como carboaluminação[3].
TMA de grau semicondutor[editar | editar código-fonte]
TMA é a fonte metalorgânica preferida para epitaxia metalorgânica em fase de vapor de semicondutores contendo alumínio, tais como AlAs,AlN,AlP, AlSb, AlGaAs, AlInGaP, AlGaN, AlInGaNP etc.O critério para a qualidade do TMA são impurezas elementais, oxigenadas e orgânicas
Referencias[editar | editar código-fonte]
- ↑ Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- ↑ Biswas, K.; Prieto, O.; Goldsmith, P. J.Woodward, S. (2005). «Remarkably Stable (Me3Al)2DABCO and Stereoselective Nickel-Catalyzed AlR3 (R = Me, Et) Additions to Aldehydes». Angewandte Chemie International Edition. 44 (15): 2232–2234. PMID 15768433. doi:10.1002/anie.200462569
- ↑ Negishi, E.; Matsushita, H. «Palladium-Catalyzed Synthesis of 1,4-Dienes by Allylation of Alkenyalane: α-Farnesene [1,3,6,10-Dodecatetraene, 3,7,11-trimethyl-]». Org. Synth.; Coll. Vol., 7
| Parte ou a integralidade do conteúdo desta página resulta da tradução de uma página originalmente presente numa Wikipédia noutra língua. A página correspondente pode ser conferida aqui. Data da tradução: 2011-12-09. |

